Waterstof met geconcentreerd zonlicht

In zonrijke landen kan met geconcentreerd zonlicht elektriciteit gemaakt worden. Vervolgens kan met behulp van die elektriciteit door elektrolyse van water waterstof gemaakt worden.
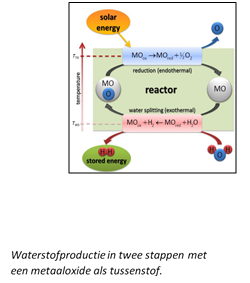
In een artikel van Xin Qian, materiaalwetenschapper aan de Northwestern University, Illinois (4), beschrijft hij hoe je zonder elektrolyse uit geconcentreerd zonlicht directer waterstof kunt maken. Dat gebeurt in twee stappen met een metaaloxide als tussenstof.
Door de hitte van het geconcentreerde zonlicht wordt het zuurstof van het metaaloxide gehaald. Vervolgens pikt het (onedele) metaal het zuurstof van het water molecuul en hebben we pure waterstof (H2)
Zie boven in de afbeelding, stap 1: Een metaaloxide wordt door de hitte van het geconcentreerde zonlicht ontleed in het metaal zelf en de zuurstof ervan. Onderin de afbeelding, stap 2: Het schone metaal onttrekt een zuurstofatoom aan een molecule H2O (water), waarna H2 (waterstof) overblijft.
Het metaal is daarbij weer het metaaloxide geworden en zo kan de cirkel eeuwig herhaald worden.
Nu is het metaal cerium veel in gebruik, maar omdat het een zeldzaam aardmetaal is, erg duur. Bovendien werkt stap 2 daarvan pas boven de 1500 °C, een temperatuur waar het reactormateriaal slecht tegen kan. De researchgroep van Xin Qian heeft nu zogenoemde perovskieten onderzocht en geschikt bevonden.
Men probeerde eerst ijzer als tussenstof. Maar ijzeroxide (roest) klonterde teveel en was te moeilijk terug te vormen tot ijzer (zie echter bron 5 en 6).
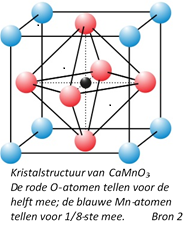
Perovskieten, genoemd naar de Russische mineraloog Perovski (1792–1856), hebben de kristalstructuur van CaMnO3, zie afbeelding.
Perovskieten leverden vóór de groep van Xin Qian ze verbeterden per gram slechts 6 mL H2/uur. Zijn ICT- collega’s voorkwamen overbodig onderzoek door computerscreening van de vele perovskiet-variëteiten. Alleen perovskieten met een goede stabiliteit, juiste kristalstructuur, een niet te laag smeltpunt en een goede snelheid voor stap 1, werden meegenomen in het verdere onderzoek. Door titaan als dope aan een van de geselecteerd perovskieten toe te voegen steeg de snelheid tot 10 mL H2/uur en daalde de werktemperaturen van de stappen naar 1350 °C resp. 1150 °C (zie de rode resp. grijze stippellijn in de eerste afbeelding). Als in de perovskiet in onderzoek de gassen waterstof en/of zuurstof zich moeilijk konden verplaatsen, werd naast de perovskiet (die als tussenstof ook al als katalysator kan worden opgevat) een tweede katalysator ingezet.
Naar: Susan Kraemer, Solar Paces, 10 maart 2021 (1)
Samenvatting, bewerking en vertaling: Harrie Jorna
Bronnen (geraadpleegd 29-9-2021)
1: Could a Perovskite make Cheaper Solar Hydrogen? – Solar PACES (Paces = stappen. HJ)
2: https://nl.wikipedia.org/wiki/Perovskieten
3: https://nl.wikipedia.org/wiki/Cerium(IV)oxide
4: Outstanding-Properties-and-Performance-of-CaTi0.5Mn0.5O3%E2%80%93d-for-Solar-Driven-Thermochemical-Hydrogen-Production
5: https://www.nvon.nl/nvox/ijzer-in-je-tank
6: Bijscholingsmateriaal bij de module “Waterstof uit Wind en Woestijn”. (Op basis van Solar thermal power plants. Heat, electricity and fuels from Concentrated Solar Power.)